
分子科学研究所在铁蛋白生物矿化分子机制研究领域取得新进展
日期:2024-05-07 | 访问量:
近日,分子科学研究所在铁蛋白生物矿化分子机制研究领域取得新进展,在国际著名学术期刊Journal of the American Chemical Society上发表了题目为“Growth Process of Fe-O Nanoclusters with Different Sizes Biosynthesized by Protein Nanocages”的研究论文。山西大学分子科学研究所为第一单位,我所王文明副教授为第一作者,王宏飞教授为通讯作者。合作者中国农业大学赵广华教授为数据分析提供了指导和帮助、上海科技大学武丽杰副研究员和南开大学郭宇教授为低温冷冻电镜结构解析供了帮助。
蛋白质具有独特的金属配位环境,能够对金属纳米团簇的形状和形态进行调控,以蛋白质为模板的金属纳米团簇和纳米粒子的合成备受关注。然而,纳米团簇在蛋白中详细的形成过程和分子机制仍不清楚。在本工作中,作者选取支原体铁蛋白作为纳米团簇合成的生物模板,合成了一系列不同大小和形状的Fe-O纳米团簇,并联合使用X射线蛋白质晶体学和低温冷冻电镜技术解析获得不同纳米团簇精确的空间结构,描绘出铁蛋白四重轴通道处单个铁原子逐步形成Fe-O纳米团簇的完整过程。其中,合成的Fe35O23Glu12是目前具有精确原子结构且含铁数量最多的Fe-O纳米团簇。这项研究工作有助于我们了解金属纳米团簇形成的分子机制,并为其他类型金属纳米团簇的合成提供了一种有效的方法和模板。
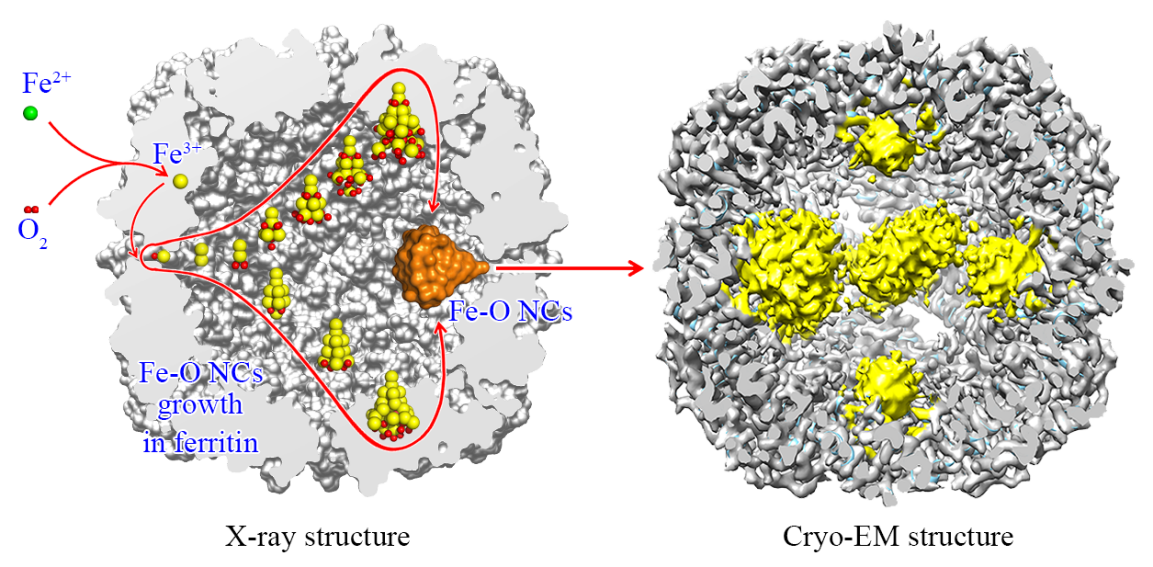
该工作得到了国家自然科学基金、山西省科技和人才计划项目的支持,晶体衍射数据与冷冻电镜数据分别在上海光源与山西省高等创新研究院冷冻电镜中心进行收集。
全文链接:https://doi.org/10.1021/jacs.3c13830

